A sejtfalat szétroncsolva pusztítja el a baktériumokat az új magyar antibiotikum
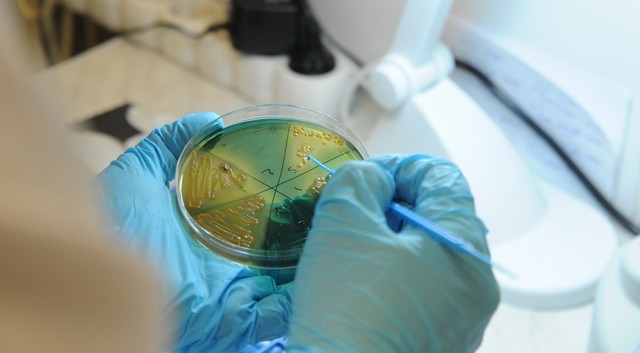
Célzottan a baktérium felszínén kialakuló szupramolekuláris peptid antibiotikumot terveztek a HUN-REN Természettudományi Kutatóközpont (HUN-REN TTK) kutatói, akik egy különleges elektronmikroszkóp segítségével azt is megfigyelték, hogy miként működnek a baktériumölő peptidek. Felvételeik szerint az új antibiotikum a sejtfalat szétroncsolva pusztítja el a baktériumokat.

Tudtad?
- A Mi az a blogger pont hu, az Egyszer már láttam autót pont hu, a Teszt a lelke mindennek pont hu, a GaszTROLL pont hu és a Trollverda pont hu honlapok, valamint a Begurulva – autó és kütyümustra és a podCARs pont hu podcast csatornák a Médiabirodalom lapcsoporthoz tartoznak!
Az Egészségügyi Világszervezet (WHO) előrejelzése szerint 2050-re a vezető halálok a hagyományos antibiotikumoknak ellenálló mikroorganizmusok miatt kialakuló fertőzés lehet. Az ellenük való küzdelemhez új típusú, egyedi hatásmódú vegyületekre van szükség. A HUN-REN TTK kutatói a közelmúltban egy lehetséges, bíztató irányról számoltak be tanulmányukban a Nature Communications című folyóiratban – olvasható a Magyar Kutatási Hálózat (HUN-REN) MTI-hez eljuttatott keddi közleményében.
Kiemelték: a WHO első, 2020-as átfogó elemzése szerint a rezisztens baktériumok 2019-ben világszerte 1,27 millió halálesetet okoztak, és ez a szám évről-évre sokszorozódik. Ezért is kerültek a kutatók vizsgálódásainak kereszttüzébe a hagyományos antibiotikumnak ellenálló szuperbaktériumok.
Az egyik út a szuperbaktériumokkal vívott küzdelemben az úgynevezett fágterápia, amikor vírussal ölik meg azokat. Ilyen irányú kutatásokat végeznek például a Szegedi Biológiai Kutatóközpontban. A másik ígéretes lehetőség pedig a teljesen új hatásmechanizmusú antibiotikumok kifejlesztése – tették hozzá.
„A baktériumok kissejtű rendszerei elképesztően adaptívak, olykor egy komplett kolónia épül fel egyetlen éjszaka alatt. Sőt, a legfrissebb kutatások szerint bizonyos baktériumok a halálukkor nanométeres nagyságú +riasztógömböket+ választanak ki magukból, átadva ezzel a túléléshez szükséges tudást társaiknak. Ez a hihetetlen alkalmazkodóképesség is azt vetíti előre, hogy több irányból kell a harcot felvenni a szuparbaktériumokkal” – magyarázza a közleményben Beke-Somfai Tamás, a HUN-REN TTK Biomolekuláris Önrendeződés Kutatócsoportjának vezetője.
„A saját szervezetünkben is vannak természetes alapú peptidek, ezeket antimikrobiális peptideknek hívjuk. Mi olyan szupramolekuláris szerkezeteket – tulajdonképpen új antibiotikumot – terveztünk, amelyek ötvözik ezeknek a természetes peptideknek a baktériumölő mechanizmusait a nem természetes vegyületek kedvező biostabilitásával” – foglalta össze a kutatás lényegét Beke-Somfai Tamás.
A kutatók eddig nem tudták igazán megfigyelni, „miként támadnak” a peptidek, a TTK kutatóinakmost viszont – transzmissziós, illetve krio-elektronmikroszkóp segítségével – sikerült végigkövetniük, hogyan rendeződnek ezek a baktériumsejtek felszínén szupramolekuláris szerkezetekbe.
A biomolekulák kutatásához használt krio-elektronmikroszkóp (cryo-EM) megalkotásáért 2017-ben kapott Nobel-díjat Jacques Dubochet, Joachim Frank és Richard Henderson. Ezek a mikroszkópok betekintést engednek a nagy méretű, akár tízezer atomot tömörítő makromolekulák térszerkezetének csodálatos világába. Segítségükkel a kutatók még több információt kaphatnak élettani szempontból fontos molekulákról, fehérjékről – olvasható a beszámolóban.
„A felvételek szerint a képződő lamellák – mintha kések lennének – belenőnek a sejtfalba és behatolnak a baktérium belsejébe. A sejtfal átszúrása szivárgást okoz, ami végül a baktérium pusztulásához vezet. A képanalízis azt is megmutatta, hogy a baktériumsejtbe behatoló lamellákból meglepően kevés is elegendő a sejtfalkárosító hatáshoz. Ráadásul a tesztek alapján a peptidek a baktériumok növekedését már rendkívül kis koncentrációban gátolják” – számolt be a vizsgálatról a kutatócsoport vezetője.
„A mikroszkópos képek és molekuladinamikai szimulációk megerősítették, hogy a peptid-alapú lamellák képződése a foszfátcsoportokkal való kölcsönhatáson alapul: már egyszerű szervetlen foszfátionok jelenlétében is olyan sávos lamelláris morfológiák alakulnak ki, amelyekben az egyes sávok két-két peptidrétegből épülnek fel, melyeket foszfátionok kötnek össze és hidrogénkötések stabilizálnak” – összegezte az eredményeket.
„A HUN-REN TTK kutatóinak munkája több szempontból is innovációnak számít: egyrészt sikeresen terveztek egy olyan peptid alapú antibiotikumot, amely célzottan a baktériumsejtekhez kötődve in-situ aktiválódik, másrészt ők az elsők, akiknek sikerült közvetlen vizuális betekintést nyerni a baktériumölő peptidek működéséről” – olvasható a Magyar Kutatási Hálózat közleményében.

